
TIPOS DE REACCIONES QUÍMICAS
Reacción de síntesis

Se forma una sustancia a partir de dos o más reactivos.

Reacción de desplazamiento
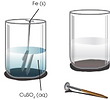
Un elemento desaloja a otro de un compuesto y lo sustituye en dicho compuesto.

Los átomos o iones componentes de dos sustancias reaccionan intercambiando su posición en dichas sustancias.
Reacción de descomposición


Reacciones de doble desplazamiento


Son aquellas en las que una sustancia se descompone en otras más sencillas.



Es una ecuación química que representa una solución de sales minerales, disociadas en iones, en un medio acuoso. Por lo general representan el comportamiento de las sales disueltas en agua, y las especies iónicas se escriben seguidas del término (aq) en la ecuación para indicar que están en solución acuosa.

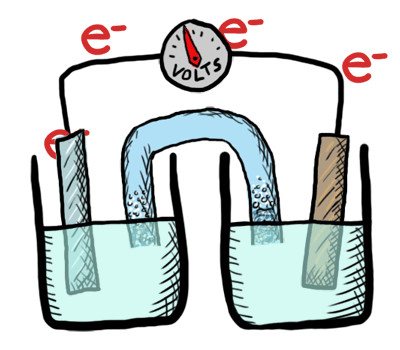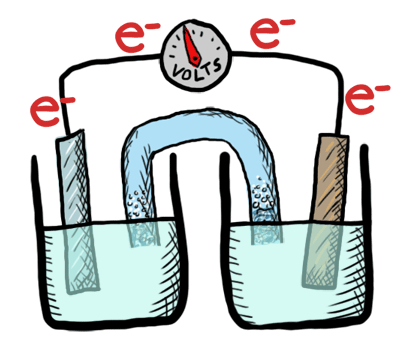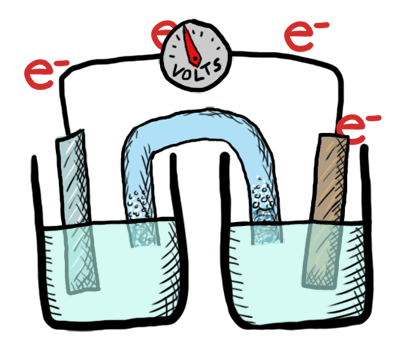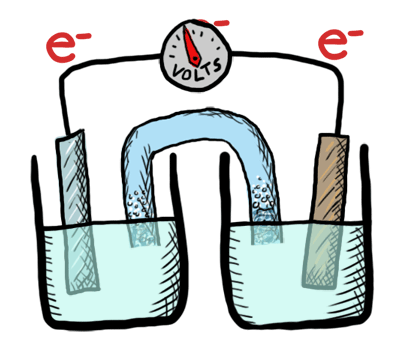

Ocurre un intercambio de electrones entre los átomos o moléculas involucrados. Ese intercambio se refleja en el cambio de estado de oxidación de los reactivos. El reactivo que cede electrones experimenta oxidación y el que los recibe, reducción.

Reacción de oxidación-reducción
Es aquella que tiene lugar mediante transferencia de electrones.


Reducción
Es el proceso de ganancia de electrones por parte de un oxidante.
Oxidación
Es el proceso de pérdida de electrones por parte de un reductor.
REACCIONES DE COMBUSTIÓN
Es la reacción de una sustancia, llamada combustible, con el oxígeno, al que llamamos comburente, en la que se desprende una gran cantidad de energía en forma de luz y calor.
En toda reacción de combustión es necesaria la presencia del oxígeno como reactivo y se obtienen, cuando el combustible es un hidrocarburo, dos productos de reacción, el dióxido de carbono y el vapor de agua.




Reacciones de neutralización

Cuando un ácido reacciona con una base se obtienen como productos una sal y agua.
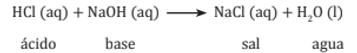
CLICK A LA PALANCA

La neutralización es la reacción entre un ácido y una base, en disolución acuosa, con formación de una sal y agua.

El pH indica la concentración de iones de hidrógeno.








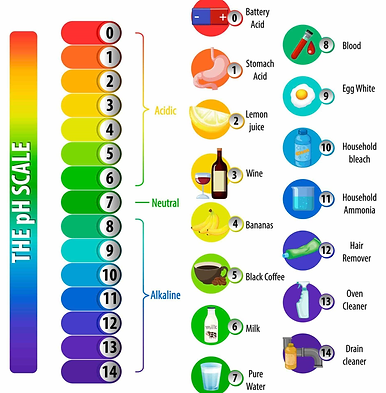
El pH es el potencial de hidrógeno de una disolución, ideado por el científico danés Søren Peder Lauritz Sørensen en 1909 e indica la concentración de iones de hidrógeno en una sustancia.





































Las reacciones reversibles son aquellas en las que los reactivos no se transforman totalmente en productos, ya que estos vuelven a formar los reactivos, dando lugar así a un proceso de doble sentido que desemboca en equilibrio químico.

Pon atención al video y al final del tema da click en el ícono para jugar.
Una reacción irreversible es una reacción química que se verifica en un solo sentido, es decir, se prolonga hasta agotar por completo una o varias de las sustancias reaccionantes y por tanto la reacción inversa no ocurre de manera espontánea.


- La ruptura de los enlaces de los reactivos requiere consumo de energía.
- La formación de nuevos enlaces en los productos libera energía.


Reacciones exotérmicas: Son reacciones en las que la ener-gía consumida en la ruptura de los enlaces es menor que laliberada en la formación de los productos.

Reacciones endotérmicas: Son aquellas en las que la ener-gía que se consume en la ruptura de los enlaces es mayorque la que se libera en la formación de los productos.
Observa el video y luego juega

Escanea o haz
click en el código
