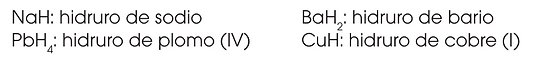FUNCIÓN SAL


Llamamos sales a los compuestos que son el resultado de la unión de un catión cualquiera con un anión distinto de H+,OH− y O2-.La mayoría de las combinaciones binarias de un metal común no metal son sales. Así tenemos, por ejemplo, el cloruro de sodio y el sulfuro de potasio.

Estos compuestos resultan de la combinación entre metales y no metales de las familias VI yVII por la neutralización total de los hidrogeniones del ácido y los oxidrilos de la base.
Sales halógenas neutras


oxisales neutras
Al hacer reaccionar un hidróxido con un oxoácido, obtenemos una sal oxisal neutra y agua.
Escanee este código Qr en tu dispositivo para aprender mas sobre los tipos de sales o presiona aquí..

En general, esta sal ternaria está formada por un elemento metálico o un ion poliatómicopositivo y un anión procedente de un oxoácido
SALES ÁCIDAS
El cloruro de amonio se usa como:
1. Diurético, actúa aumentando la excreción renal
2. Acidificante
3. Reactivo para la fabricación de pilas secas y para el galvanizado.
A estas sales las obtenemos por la neutralización parcial de los H+ del ácido y los OH- de la base o hidróxido o por la sustitución parcial de los hidrógenos de los ácidos por cationes metálicos. Una de las sales ácidas más utilizadas es el cloruro de amonio. El cual se produce mediante la siguiente reacción:
SALES halógenas ÁCIDAS
En este caso para formar la sal emplearemos un ácido hidrácido y una base.
En la reacción se ha eliminado una molécula de agua y el H libre pasa a formar parte dela sal.
Formulación: Escribimos el símbolo del metal seguido del hidrógeno y posteriormente el no metal.
Nomenclatura
• Tradicional: sulfuro ácido de sodio
• Stock: hidrógeno sulfuro de sodio (I)
• Sistemática: monohidrógeno monosulfuro de sodio
oxisales ÁCIDAS
Son semejantes a las ácidas halógenas, pero, en este caso, empleamos iones poliatómicos provenientes del oxoácido, los hidrógenos libres pasan a formar parte de la sal.
Nomenclatura
• Tradicional: Fosfato ácido de litio
• Stock: Dihidrógeno fosfato de litio (I)
• Sistemática: Dihidrógeno monofosfato de litio
Aplicaciones: Se usan en la medicina, industria alimenticia y en la fabricación de productos de limpieza
Sales básicAS
Estas sales son similares a las ácidas, pero en lugar de quedar libres los H+, sobran los OH-, en otras palabras la neutralización es parcial y quedan libres los iones oxidrilos. Hay dos clases de estas sales, las halógenas básicas y las oxisales básicas.
Sales halógenas básicas
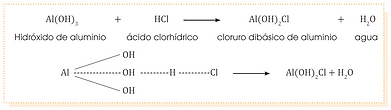
Formulación:
El símbolo del metal seguido del grupo hidroxilo y después el no metal.
Nomenclatura
• Tradicional: Cloruro dibásico de aluminio
• Stock: Hidróxi cloruro de aluminio
• Sistemática: Dihidroxi cloruro de aluminio
Sales oxisales básicas
Formulación: El símbolo del metal seguido del grupo hidroxilo y después el ion poliatómico.
Nomenclatura
• Tradicional: Nitrato básico de calcio
• Stock: Hidróxi trioxonitrato de calcio
• Sistemática: Hidroxi nitrato de calcio
Utilización de los iones poliatómicos

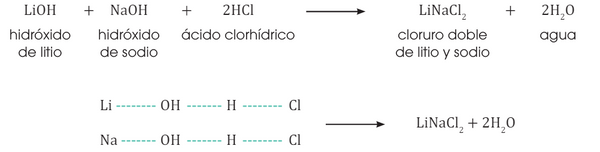
Sales dobles
Son compuestos que resultan de la sustitución total de los hidrógenos del ácido por dos metales diferentes, también estas sales pueden ser halógenas y oxisales.
Sal halógena doble
oxisal doble
Formulación: Escribimos primero los símbolos de los metales seguido del símbolo del no metal o del ión poliatómico.
Nomenclatura: Utilizamos los nombres en la forma tradicional.
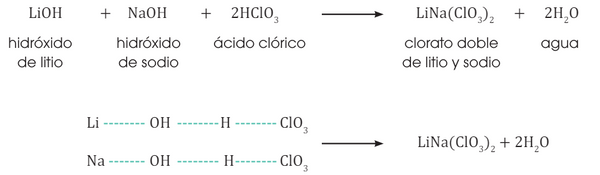
Resultan de la reacción de dos ácidos con un hidróxido.
SALES MIXTAS

SAL halógena mixta
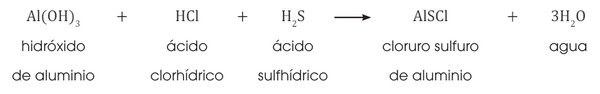

oxisal mixta
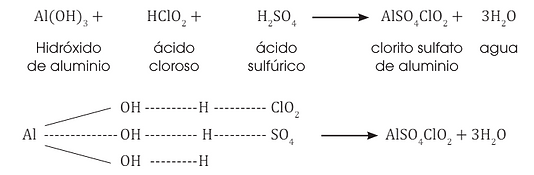

Formulación: Escribimos primero el símbolo del metal seguido de los símbolos de los ácidos
Nomenclatura: Utilizamos los nombres en la forma tradicional.4.12.
Son las combinaciones binarias del hidrógeno con metales.
En ellas, el hidrógeno actúa con número de oxidación −1 y la mayoría de los metales actúa siempre con un único número de oxidación.
Función HIDRURO