
Modelo mecánico-cuántico de la materia
Dualidad del electrón
-
Como el electrón se mueve alrededor del núcleo, pierdeenergía, y esta pérdida conduciría a que el electrón se des-truya, sin embargo necesita otra explicación para establecerotro modelo atómico que, además de ofrecer explicación alos fenómenos observados, no vulnere las leyes de la física.
-
En 1905, A. Einstein puso en cuestión la teoría clásica de laluz, donde esta presenta comportamiento corpuscular.A partir de esta hipótesis, el físico francés Louis de Broglie pro-puso, en 1924, que de igual modo que la luz, los electronespodrían presentar propiedades ondulatorias.

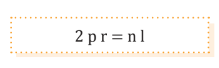
Cualquier partícula de masa (m) y velocidad (v) debe considerarse asociada a una onda cuya longitud de onda (λ) viene dada por la expresión:
Por tanto, la longitud de la órbita del electrón debe ser un número entero, el cual se asocia para tratar una onda estacionaria. Así, las únicas órbitas permitidas son las que dan lugar a una onda estacionaria.
Según sea el valor de niveles energéticos (n) y el valor de l, el radio de la órbita debe tomar
valores determinados que corresponden a los radios de las órbitas permitidas.
Espectro electromagnético

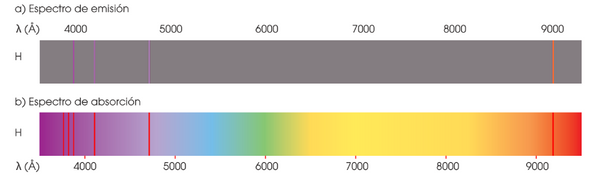
Espectro de emisión del hidrógeno
El espectro de emisión del hidrógeno es el más sencillo de todos y, por ello, el más estudiado.Se compone de varias series de bandas, que aparecen en la zona ultravioleta, en la visibley en el infrarrojo.


APRENDAMOS
JUGANDO
Clic para acceder al juego Espectro electromagnético