
Balanceo o ajuste de ecuaciones químicas


Siga estas normas por favor.
Las ecuaciones químicas siguen una serie de normas de escritura e interpretación que lespermite tener un signiicado unívoco.



En el primer miembro se escribe los reactivos y en el segundo los productos. Si hay varios reactivos o varios productos, se separan mediante el signo +.
Se separa los dos miembros de la ecuación mediante una flecha que indica el sentido de la transformación.
En la ecuación solo se describe el curso principal de la reacción. No constan los pasos intermedios que pudieran tener lugar, solo el estado inicial (reactivos) y el final(productos).
Solo se escribe las sustancias que intervienen propiamente en la reacción. No se hace constar, por ejemplo, el agua de disolución.
Frecuentemente, se indica el estado físico de las sustancias que intervienen. Después de la fórmula se añade los símbolos (s), (l), (g) y (aq).
En ocasiones, se emplea algunos símbolos para identificar otras características del proceso.
El símbolo ∆, colocado sobre la flecha, indica el sentido de la transformación, significa "calentamiento".
Una flecha para arriba junto a un producto significa ‘desprendimiento de gas’.
Una flecha para abajo junto a un producto significa ‘formación de un precipitado sólido’.



Ajustar una ecuación química consiste en asignar a cada fórmula un coeficiente adecuado de modo que en los dos miembros haya el mismo número de átomos de cada elemento.
Método de tanteo
Se utiliza en ecuaciones sencillas. Consiste en aplicar el método de ensayo-error.
1. Escribir la ecuación desbalanceada
2. Revisar los coeficientes y subíndices estequiométricos
CH4 + O2 → CO2 + H2O
3. Balancear primero los átomos en menor proporción
4. Balancear por los átomos de oxígeno
CH4 + 2O2 → CO2 + 2H2O
4 O 4O
5. Balancear por último los átomos de hidrógeno
CH4 + 2O2 → CO2 + 2H2O
4 H 4H

Método del sistema de ecuaciones
Se emplea en los casos en que resulta más complicado asignar los coeficientes por tanteo. Consiste en plantear tantas ecuaciones como tipos de átomos intervienen en la reacción.
1. Se asigna a cada fórmula un coeficiente provisional: a, b, c, d.
2. Se establece una ecuación para cada elemento. Esta ecuación indica que el número de átomos de dicho elemento es igual en ambos miembros. Es decir:
Para el nitrógeno: a = c
Para el oxígeno: 2b = c + d
Para el hidrógeno: 3a = 2d
3. Como hay más incógnitas que ecuaciones, se debe asignar un valor arbitrario a una de ellas, por ejemplo:
a = 2 2 = c 2b = c + d 6 = 2d
4. Se resuelve el sistema: a = 2 (por convenio)
5. Se sustituye los coeficientes provisionales por su valor:
6. Si se quiere evitar los coeficientes fraccionarios, basta multiplicar todos por 2. En este caso, la ecuación ajustada queda así:


Aprendamos más....

Observa el video y después practica AQUÍ

Observa el video y después practica AQUÍ
Método de balanceo ion – electrón
El método se puede utilizar tanto en medio ácido como básico y dependiendo de ello su forma de aplicación es distinta.
1. Si la ecuación está en forma molecular se la pasa a forma iónica. Se tiene en cuenta que los elementos libres, los óxidos, el H2O y el H2O2 no se disocian, solo sedisocian los electrolitos (ácidos, bases y sales). Por ejemplo:
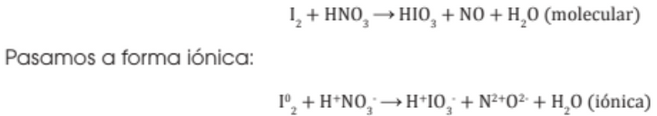
2. Se escribe por separado el esqueleto de las ecuaciones iónicas parciales del agente oxidante y el agente reductor.
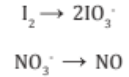
Balanceamos por tanteo (inspección) los átomos distintos de H y O:
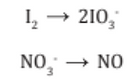
3. Se iguala los átomos de oxígenos agregando moléculas de H2O para balancear los oxígenos:
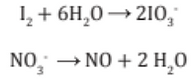
4. Se iguala los átomos de hidrógenos H+ (iones hidrógenos) donde falta hidrógeno.
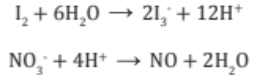
5. Se cuenta la carga total en ambos lados de cada ecuación parcial y se agrega (e-) en el miembro deficiente en carga negativa (-) o que tenga exceso de carga positiva (+).
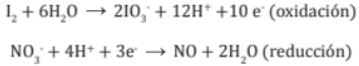
6. Se iguala la ecuación con el número de (e- ) tanto perdidos como ganados. Después se multiplica las ecuaciones parciales por los números mínimos necesarios.
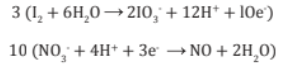
7. Se suma las dos medias reacciones cancelando cualquier cantidad de iones H+,OH- o H2O que aparezca en ambos lados, con lo cual obtiene la ecuación finalmente balanceada.
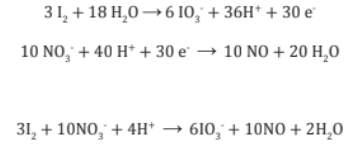
Suma -->
NOTA:
- Si la ecuación fue dada originalmente en forma iónica, esta es la respuesta del problema.
- Si la ecuación fue dada originalmente en forma molecular, se traslada estos coeficientes a la ecuación molecular y se inspecciona el balanceo de la ecuación.

Método de balanceo de óxido–reducción o redox
En este método es primordial conocer los números de oxidación de estas especies, ya que revelan cuántos electrones han ganado o perdido por mol.
1. Se asigna el número de oxidación de todos los elementos presentes en la reacción y se reconoce los elementos que se oxidan y reducen.
Nota: Todo elemento libre tiene número de oxidación cero.
2. Se escribe las semirreacciones de oxidación y reducción con los electrones de intercambio.

3. Se balancea el número de átomos en ambos lados de las semirreacciones. En este caso están balanceados.
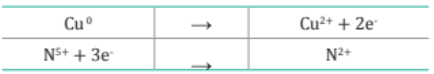
4. Se iguala el número de electrones ganados y cedidos.
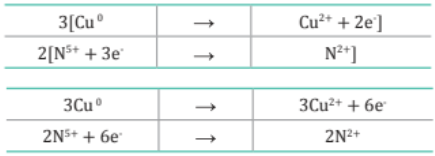
Nota:
El número de electrones ganados debe ser igual al número de electrones cedidos.
Se coloca los coeficientes encontrados en la ecuación original donde verificamos el cambio del número de oxidación.
5. Se completa el balanceo ajustando el número de átomos en ambos lados de la
reacción.
Aprendamos más....
Observa el video y después practica AQUÍ
Observa el video y después practica AQUÍ

¡Práctica y perseverancia te ayudará, para ser un gran químico!