
El átomo está formado por:
Núcleo
-
Protones
-
Neutrones
-
Electrones en susorbitales, cuyo número varía según el elemento químico.
Teoría de Dalton
En 1808, John Dalton enunció su célebre teoría atómica que justifica estos postulados.
• La materia está formada por pequeñas partículas, separadas e indivisibles, llamadas átomos.
• La materia que tiene todos sus átomos iguales es un elemento.
• Los átomos de los diferentes elementos se distinguen por su masa y sus propiedades.
• Los átomos de elementos distintos pueden unirse en cantidades fijas para originar compuestos.
• Los átomos de un determinado compuesto o átomos compuestos son también iguales en masa y en propiedades.

Tres años más tarde, en 1811, el químico italiano AmadeoAvogadro denominó moléculas a los átomos compuestosde Dalton.
Teoría de Thomson
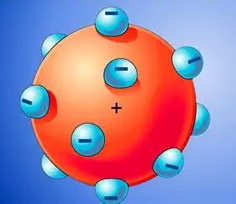
En 1904, Joseph J. Thomson propuso un modelo muy elemental: el átomo está constituido poruna esfera de materia con carga positiva, en la que se encuentran encajados los electronesen número suiciente para neutralizar su carga.
La distribución de las cargas propuesta por Thomson explicaba la aparición de los rayoscatódicos y los rayos canales:
• Al desprenderse los electrones de los átomos, forman los rayos catódicos, que se des-plazan hacia el ánodo.
• El resto del átomo, con carga positiva, se dirige hacia el cátodo y forma los rayoscanales.

En 1911, el físico americano R. Millikan determinó experimen-talmente el valor de la carga del electrón. De ese dato, y deotros anteriores, se dedujo el valor de su masa.
Carga del electrón: −e = −1,602 189 × 10−19 C
Masa del electrón: me = 9,109 534 × 10−31 kg
Teoría de Rutherford


En su experiencia, Rutherford dedujo que en el centro del átomo hay un diminuto corpúsculo, al que llamó núcleo, en el que se encuentran las partículas de carga positiva, los protones. Además, ya intuyó la presencia de neutrones en el núcleo.
El Modelo de Rutherford explicaba los resultados de su experimento:
– Las partículas α que pasan lejos del núcleo no se desvían porque la corteza electrónica prácticamente no las afecta.
– Las partículas α que pasan cerca del núcleo se desvían porque éste las somete a repulsión electrostática.
– Las partículas α que chocan directamente contra el núcleo rebotan y son repelidas violentamente, por tratarse de cargas del mismo signo.
Elementos químicos e isótopos

El número atómico Z, de un elemento químico representa la carga nuclear positiva de sus átomos, es decir, el número de protones que estos contienen en el núcleo.
Así, un elemento químico se caracteriza por su número de pro-tones o número atómico. Si el átomo es neutro, este valor coincide también con el número de electrones.
El número másico A, de un átomo es el nú-mero de nucleones que contiene su núcleo,es decir, la suma de los protones y neutronesque lo forman.